Onkologiya-
B.P.Kopnin
Rak ruski istraživački centar. Blokhin RAMS, Moskva
izvor RosOncoWeb.Ru
01 0203 0405 06073.3. p53 - višenamjenski Tumor supresor više vsegoporazhaemy u različitim humanim tumorima
3.3.1. Vrste tumora povezanih s abnormalnom p53
Najuniverzalniji molekularne promjene u različitim novoobrazovaniyahcheloveka je inaktivacija funkcije p53 proteina. Više od polovinevseh humanih tumora (tumori 50-60% tijekom 50) otkriven razlichnyhtipov mutacija p53 gena. Za razliku od drugih opuholevyhsupressorov, naznačen mutacijom, zaustavljanje sintezbelka (delecija, formiranje zaustavna kodona koji kodira pomak okvira povreda mRNA), velika većina (90%) spoja iz mutacije p53 je missens-mutaciju vodi do zameneodnoy od amino kiselina u proteinske molekule na drugu. Još odnoyosobennostyu p53 mutacije u tumorskih stanica čime oni, za razliku od drugih za suzbijanje tumora mutacije, heterozigotnih chastoyavlyayutsya, tj To utječe samo na jedan od dva alleleygena. (Razlozi za ove razlike će biti objavljeni u nastavku, rassmotreniistrukturnoy organizacija i funkcije p53 - vidi odjeljak 3.3.2.).
Mutacije se nalaze u različitim dijelovima molekule p53, već u chaschevsego evolucijski očuvan domene DNA-vezivanja, te s najvećom učestalošću u kodona 175, 245, 248, 249, 273rd 282 (tzv vruće točke) - vidi sliku .. 2. Zanimljivo, spektar mutacija varira pomalo ovisno o gistogenezaopuholi i / ili poremećajem. Na primjer, mutacije u kodone175 nije pronađen u tumorima pluća, i zamijeniti drugi goryacheytochke - kodon 273 - ne može se otkriti Eksplozija kriza hronicheskogomieloidnogo leukemije. U isto vrijeme, za rak pluća harakternymutatsii na kodona 145, to je vrlo rijetko naći u drugim tumorima, te mutacije u kodon 249 nalaze se prvenstveno u hepatocarcinoma uzrokovane specifičnim kancerogen - aflatoksina B. Očito odraz djelovanja kancerogenih tvari s različitim mehanizmima mutagennogodeystviya su i razlike u prirodi p53 mutacije u različitim opuholyah.Tak, u tumorima pluća, jetre i limfomima aminokislotnyhostatkov zamjenu u većini slučajeva zbog transversions (u DNKpurinovy nukleotida zamjenika NEN na pirimidina ili obrnuto) priori karcinomi kože, Burkittov limfom, leukemije T-stanica (- prijelaza zamjenom baze purine za drugu purina ili pirimidina pirimidinovogona drugi).
Zametna (došlo u zametnim stanicama i prenosi ponasledstvu) mutaciju u jednom alela gena p53 uzrok sindromLi-Fraumeni, sadrži razvitiyurazlichnyh urođenu sklonost, posebno neoplazma sarkome molochnoyzhelezy raka, limfocitnih leukemija. Često, Li-Fraumeni sindrom harakterizuetsyavozniknoveniem više primarnih tumora. Važno je napomenuti da je u transgeničnih miševa koji nose deaktivaciju mutacije u gener53, tu je slika, to je vrlo podsjeća na Lee Fraumeni.Primerno sindrom trećine životinja koje su inaktivirani jedan od dvuhalleley p53, u roku od 6-9 mjeseci nakon rođenja, tu su tumori i njihov raspon je vrlo slična onoj koja je nađena u sindroma Li-Fraumeni.Pri ovaj dio ovih tumora, kao i tumora kod patsientovs Li-Fraumeni sindroma nepovrezhdennogoallelya zadržao ekspresiju gena p53. U kongenitalne inaktivacije u svim stanicama organizmaoboih alela tumora p53 razvija u gotovo vsehzhivotnyh. Otprilike ista slika se vidi u transgennyhmyshey nosi dodatne egzogeni p53 alel, kodiruyuschiybelok missens mutaciju.
Važno je naglasiti da mutacije - nije jedini način narusheniyafunktsii proteina p53 u stanicama tumora. Dakle, za 10-20% molochnoyzhelezy raka, kao i neuroblastoma karakteristične povrede transportar53 iz citoplazme u jezgru gdje se pokazuje svoju funktsionalnuyuaktivnost. Kao dio osteosarkomi kletochnogoonkogena opaženo umnožavanje MDM2, proizvod koji se veže na i inaktivira belokr53 (vidi, odjeljak 3.3.3). U raka vrata maternice, papilloma virusi assotsiirovannoms ljudski, vezanje p53 virusnymonkobelkom E6), što uzrokuje degradaciju p53 proteina, itd
3.3.2. Strukturna organizacija i biokemijski belkar53 aktivnost
Produkt gena p53 ima mol. mase 53 kDa velik i sastoji se od 392 aminokislotnyhostatkov. Tvori tetramerna kompleksa sposobnog regulirovattranskriptsiyu broj gena koji su u strukturi DNA spetsificheskieposledovatelnosti, nazvan p53 osjetljiv politi elementy.V molekula p53 mapiran više funkcionalno značajna područja, koja igraju važnu ulogu u provedbi i regulaciju njegovog djelovanja (Sl. 2).
N-terminalni dio (aminokiseline 1-42) je odgovoran za domene aktivacije transkripcije ciljnih gena. Onobladaet sposobnost vezanja za komponente bazalnih faktorovtranskriptsii, naročito podjedinice hTAFII31, hTAF70 kompleksaTFIID RNA polimerazom II, kao transkripcijski kofaktoromp300 / CBP. Osim toga, ova domena uključeni u interakcije protein-protein koji reguliraju stabilnost p53. I na kraju, to raspolozhenoneskolko serin i treonin fosforilacije kotoryhreguliruet aktivnost p53.

Sl. 2. Shematski prikaz funkcionalnih domena p53, predloženi stjecanje model proteina transkripcijski aktivnoykonformatsii a incidencija tumora chelovekamutatsy u različitim područjima molekule p53.
Središnje domene p53 (amino kiseline 120-290) i veže neposredstvennouznaet reguliruemyhgenov pojedinih DNA slijedova, takozvane p53-reaktivne elemente koji se sastoje izraspolozhennyh uzastopnih sekvenci obobschennoystrukturoy tip PuPuC (A / T) (A / T) GPyPyPy (Pu - purin, Py - pirimidin) .Imenno domeni DNA vezanja lokalizirana bolshinstvotochechnyh mutacije pronađene u različitim humanim tumorima (slika 2) ..
Zatim dolaze područja odgovorna za nuklearnu lokalizaciju (aminokisloty305-323) i dimerizacije / tetramerization molekula p53 (aminokisloty323-356). C-terminalni dio (aminokiseline p53 363-392) predstavlyaetsoboy naziva inhibitorni domene. U nemodifitsirovannomsostoyanii sadnje sprječava domenu za vezanje DNA spetsificheskuyuposledovatelnost reguliranog gena. Fosforilacija i atsetilirovanieego određena mjesta uzrokuju konformacijske promjene i p53 belkovoymolekuly tetramer prijelaz iz neaktivnog (latentni) za aktivan. Kao rezultat toga, DNA domene za vezanje osvobozhdayutsyaot blokirajući učinak i inhibitorne domene steći sposobnostsaditsya p53 koja odgovaraju elementima. Tako, prema osnovnim faktora uključenih responsivnymgenam transkripcije svyazyvayuschiesyas N-terminalni dio i p53 stimulira sintezu RNA ciljnih gena.
Uz povećanje transkripciju gena koji sadrže spetsificheskieresponsivnye elemente, p53 je također blizu drugihaktivnostey. Konkretno, to može potisnuti transkripcija gena mnogihdrugih takve protooncogenes BCL2, jun i FOS, gen fibronektinai itd Osnova ovog trans-represiju je nekoliko mehanizama: vezanja i izdvajanja aktiviranog p53 faktorovtranskriptsii baznog broja (P300 / CBP, TBP, CBF) - i sposobnost vezanja specifičnim genima rekrutirovatk histon deacetilaze (HDAC), itd remodeliruyuschiehromatin- Osim toga, p53 veže na proteine vovlechennymiv replikacije DNA ili popravak, i kao posljedica, modulirati etiprotsessy. Tako, interakcijom s RP-protein, on inhibira aktivaciju egosposobnost polimeraze A i D, DNA chegoyavlyaetsya rezultat inhibicije replikacije DNA. Povezuju komponente kompleksaTFIIH (ERCC2, ERCC3 et al.), To će uključiti funkciju p53 i time stimuliruettem odstranjenje popravak DNA. Vezanja p53 uz belkomRad51 dovodi do stimulacije DNA rekombinacije DNA i povećanje effektivnostireparatsiyu pauze dvostruke uzvojnice. Sudjelovati u p53 reparatsiiDNK također pokazuje svoju sposobnost da bude aktivan 3`-5`-ekzonukleazyi prepoznati dijelovi jednolančane DNA i / ili nesparenih bazama.

Sl. 3. Shematski prikaz različitih prilagođavanja, sostoyaniyr53 prepoznali specifičnih antitijela. Onkogeni mutatsiivyzyvayut nepovratne tranzicije molekule u denaturirani države, na kojoj se otvara prethodno nedostupna stanice i obrnuto, nestaju, neke ranije dostupne epitope.
Specifične tumorske stanice misscnsc mutacije dovode krezkomu promjene u konformaciji proteinske molekule p53 (slika 3) Chtov uvelike utječe na sve gore navedenog aktivni. Postoji gubitak ili slabljenje sposobnosti vezanja i aktivirovatgeny s p53 koji reagiraju elemenata potisnuti drugi cilj spetsificheskiegeny inhibiraju replikaciju DNA i stimuliraju reparatsiyuDNK. Osim toga, budući da p53 oblikuje tetramerni kompleks mutacije jednog alela genskog produkta p53 i izaziva inaktivaciju drugog alela netaknut. Činjenica da se mutant p53 protein su coexpressed Normalni ili formiranje neaktivni Heteromerne kompleksy.Takim način mutantni protein inhibira funkciju p53 normalnogobelka dominantnim negativnim mehanizmom. Očigledno, imennoeta značajka mutanta p53 uglavnom otvetstvennaza njihov onkogeni potencijal. U korist ovog totfakt pokazuje da je uvođenje kratki polipeptid domene sootvetstvuyuschegooligomerizatsionnomu p53 stanica daje polnotsennyhtetramernyh nastajanje kompleksa p53 i uzrokuje tumor transformatsiyu.Neobhodimo napomenuti da osim gubitka normalnu funkciju p53, p53 mutanata s aminokiselinskih supstitucija u žarišta (kodony175, 248 i i sur.) steći nova svojstva koja nisu svojstvena belkur53 divljeg (dobitak-of-funkcije). Tako, opisani priobreteniemutantnymi sposobnost aktivacije p53 promotore i protoonkogenovMYC ERB1, anti-apoptotički bcl-2 gena, porodicu BGL1 genaMDR1, određivanje višestruku ustoychivostkletok itd Pretpostavlja se da je to zbog mutant p53 sposobnostyunekotoryh vezujući proteini, posebno druge faktorytranskriptsii s kojima normalno p53 ne reagiraju, imodifitsirovat izražavanja gena koji su regulirani ovim transkriptsionnymifaktorami.
3.3.3. Fiziološke funkcije p53 i njihove povrede neoplasticheskihkletkah
proteina p53 molekula može biti u raznim konformatsionnyhsostoyaniyah u kojoj imaju različite biokemijske aktivnostyamii služe različite fiziološke funkcije. U konvencionalnim usloviyahr53 pohranjenih u tzv latentnom obliku u kojem obladaetslaboy transkripcijske aktivnosti. Takva P53, međutim, svyazyvaetbelki strojevi zadovoljštine (vidi gore). Eksponata 3`-5`-ekzonukleazyi aktivnost potiče rekombinacije i popravka DNA. Stressahi u različitim unutarstaničnih lezija pojaviti poslije translyatsionnyemodifikatsii, posebno fosforilacije i acetilacija opredelennyhaminokislot p53 molekule, određivanje prelazak u tako nazyvaemuyustressovuyu konformaciji. Kao p53 znatno stabilniji (t.e.rezko poveća količina u stanici) i učinkovito trans aktivirali / ili specifične ciljne gene trans-represiju indukcije sledstviemchego u nenormalnih stanica ili zaustavljanje ili kletochnogotsikla apoptozu. Nadalje, aktivacija p53 dovodi do izmeneniyuekspressii neke gene od izlučenih faktora, rezultatechego može varirati množenja i migracija ne samo oštećen, ali i okolne stanice. Dakle, u velikoj mjeri, dok je u stresnom konformaciju p53 je gubi aktivnosti stimuliruyuschierekombinatsiyu i / ili popravak DNA.
p53 divljeg tipa, osim latentne i stresnog mozhetvremenno steći i takozvani mutanti konformacije skhodnuyus ona u kojoj p53 molekula ireverzibilno kreće u onkogennyhmutatsiyah. Prolazan prijelaz mutant p53 konformacija proiskhoditpri izložena nekim citokinima i / ili morphogen (PDGF, trombopojetin, retinoična kiselina, itd). Takogoperehoda biološko značenje je nejasno. Možda je pun inaktivatsiirost koji inhibiraju aktivnost p53 i / ili promijeniti svoj set ciljnih gena.
Dakle, p53 igra važnu ulogu sigurnosti, što je na obraznomuvyrazheniyu D.Lane, "čuvar genoma", Povsednevnayafunktsiya je, očito, u prepoznavanju i ispravleniioshibok uvijek dešavaju prilikom replikacije DNA. Kada massivnyhpovrezhdeniyah DNA drugih poremećaja ili unutarstanični ugrozeih pojava prebacuje p53 funkcije (slika 4.): stjecanje transkripcijsku aktivnost i mijenjajući ekspresiju ciljnih gena, to uzrokuje ili abnormalna stanična proliferacija stanica (vrijeme za popravak oštećenja ili ireverzibilno) ili njihove smrt (faktora koji određuju sudbinu stanica će rassmotrenynizhe aktivaciju p53). Kao rezultat eliminira mogućnost akumulacije u organizmegeneticheski modificirane stanice.
Mehanizam aktivacije p53 u stres i unutarstanične povrezhdeniyah.Aktivatsiya transkripcijskih funkcije p53 je promatrana u većini raznoobraznyhstressah i unutarstaničnim povrede: UV i g-zračenje, prisutnost slomljena stanične DNA, spuštanje intracelularne bazen nukleotida, inhibiciju DNA i RNA polimeraza, prekomjerne ekspresije onkogena, virusne infekcija, hipoksije, oksidativni stres, hipo- i hipertermiju, različitih poremećaja stanične arhitekture (povećanje broja jezgara i citoskeletne mijenja adhezije), itd
Ključnu ulogu u stabilizaciji p53 proteina i povećati njen transkriptsionnoyaktivnosti igra mijenja interakciju s p53 proteina ingibitoromMdm2 gena, koji je potencijalni onkogena. Mdm2svyazyvaetsya protein s N-kraju molekule i koji ima p53 aktivnosti E3ubikvitin ligaze stimulira ubikvitinacije i, kao rezultat, proteasoma razgradnju proteina p53. Dakle, normalna razina ekspressiir53 je vrlo niska, a životni vijek je samo oko 30 minuta. Nadalje, vezanje na N-terminalnom dijelu p53 u rayonedomena interakciji s osnovnim faktorima transkripcije, MDM2 inhibira sposobnost da p53 ciljnih gena trans-aktivirati.
A)

B)

Sl. 4. Sigurnosne funkcije p53.
A). funkcije "latentan" i "stresno" formr53.
B) Čimbenici koji uzrokuju aktivacije transkripcije p53, p53 gena misheniaktivirovannogo i utjecati na njihovu biologicheskieeffekty izraz.
Kada intracelularni poremećaja, osobito kada se pojavljuje povrezhdeniyahDNK fosforilaciju p53 na mjestima (Ser15, Ser20, Ser33), postavljen u području spajanja sa proteinom MDM2. Takoefosforilirovanie provodi specifične kinaze (ATM, ATR i svoj cilj - chekpoyntkinazy CHK1 CHK2), koji aktiviruyutsyav odgovor raznih poremećaja strukture DNA (. Vidi točku 3.11.1) .U toga, ATM fosforilira i proteina MDM2. Kao blokiruetsyasvyazyvanie rezultat p53 na MDM2, što uzrokuje stabilizaciji molekula p53 ipovyshenie svoje transkripcijske aktivnosti. U nekim promjenama drugihvnutrikletochnyh, kao što je kada je ekpressii aktivirovannyhonkogenov RAS stanica, također primijetio interakcija kršenje r53i MDM2, ali to se događa zbog povećane ekspresije proteina pARF, alternativni okvir čitanja produkt gena INK4a (vidi. Razdel3.4). PARF protein sposoban za vezanje ili N-kontsevymuchastkom p53 na MDM2 ili proteina, čime se sprečava njihovo izravnu interakciju s drugom. Zanimljivo je da je gen MDM2 sama transkripcije meta aktivirovannogor53. Kao rezultat uspostavljene regulacijskog kruga, stimuliruyuschayadegradatsiyu proteina p53 nakon zatvaranja faktora vyzyvayuschihego fosforilacije proteina ili vezanje pARF.
Važnu ulogu u stjecanje molekule p53 konformacija sposobnoytrans aktivirali ciljnih gena također imaju modifikaciju C-kontsevogouchastka, naime njegove specifične aminokislotnyhostatkov acetiliranje. Kada oštećena DNA i ekspresiju aktiviran onkogenaRAS ovih zbivanja iniciranih vezanja istječe iz Mdm2N-terminalnom dijelu p53 s bazalni transkripcijski faktor P300 / CBP, acetiliranje prvi inhibitorsku domenu p53 na lizin 373 i382, a zatim (nakon vezanja p53 koji odgovaraju elementima) i kromatina proteina u područje ciljnih gena. Tako posledovatelnyepost-translacijske modifikacije N-terminalne i C-terminalne uchastkovr53 uzrokuje povećanje količine proteina p53 u stanicama, priobretenieim sposobnost povezivanja elemenata osjetljivih na p53 i rekrutirovatk geni ciljanje osnovne transkripcijskih faktora (komponente kompleksaTFIID RNA polimeraze II i histon acetylase P300 / CBP , dekondensiruyuschiehromatin), čime se stimulira transkripciju njihove mRNA.
Pod nekim stresom, osobito tijekom hipoksije, nablyudayutsyapost-translacijske modifikacije p53, što uzrokuje ne prelazak kklassicheskoy stresnog konformaciju i njegovu varijantu. Kao r53ne trans-aktivira gene koji sadrže p53 osjetljiv-elemente, ali potiskuje transkripciju drugih ciljnih gena. To tako nazyvaemayarepressionnaya oblik i fosforilirani na N-terminalnom kraju, ali je C-kontsevoyuchastok ne acetilirani i povezuje repressionnye kompleksa Sin3 / HDAC, što uzrokuje kondenzaciju kromatina ciljnih gena.
P53 ciljne gene i njihove funkcije. Trenutno, osim MDM2, koji pruža regulaciju p53 na leđima (vidi. Gore), identificirali više od stotinu gena koji su mishenyamitranskriptsionnyh aktivnost p53. Oni se mogu podijeliti naneskolko skupine na temelju njihovih fizioloških funkcija (Sl. 4B).
Prva skupina uključuje gena čiji proizvodi reguliraju kletochnyytsikl. Najvažnija od njih je protein p21Waf1 / CIP1 - ingibitortsiklinzavisimyh kinaza iz obitelji CIP / Kip. Povećava svoj ciklus uhićenje ekspressiivyzyvaet stanica u fazi G1 kasno, da obuslovlivaetsyasvyazyvaniem ciklin E / Sdk2, potiskivanje sposobnostifosforilirovat obitelji proteina pRb i puštanje transkriptsionnyefaktory E2F (vidi. Odjeljak 3.2.2). Mehanizam za umnožavanje ostanovkiperehoda od G1 do S je supresija aktiviranog p53 transkriptsiigena DP1 - transkripcijski faktor koji se veže na E2Fi tvori kompleks aktivnog, aktivirajući sintezproduktov stvarno potreban za ulazak u fazu S. vnimaniyasposobnost zaslužuje poboljšanje ekspresije p53 Siah1 genskog produkta razgradnje kotorogostimuliruet b katenina - transkripcijski faktor koji aktivira transkripciju ciklin D gena i onkogena myc (vidi odjeljak 3.4.2), koji se dalje doprinosi indukcije ostanovkikl točan ciklus u G1. Imajte na umu da može p53 podavlyataktivnost CDK2 ne samo promjenom transkriptsionnyhfunktsy, ali zbog protein-protein interakcije, a vezanje imennoneposredstvennogo ciklin H - komponenta kinaznogokompleksa CAK, aktiviranjem izvođenja fosforilacije tsiklinzavisimyhkinaz.
Identificirali broj ciljnih gena p53 proizvoda kotoryhvyzyvayut zaustaviti u fazi G2 (kašnjenja je vidljivo kada je p53 već se aktivira nakon što stanica je prošao G1-kontrolne točke, ili stanice inaktivirane G1-kontrolne točke). Aktivirovannyyr53 kompleks inhibira funkciju ciklin B / Cdc2, igranje klyuchevuyurol prijelaz od G2 u mitozi, putem nekoliko mehanizama. Prvo, ona aktivira trans-14-3-3-a gen čiji proteinski produkt svyazyvaeti sekvestrira ciklin B / Cdc2 u citoplazmi, a ne davayavozmozhnosti su dobili u jezgru, gdje bi trebali biti svoyuaktivnost. Drugo, aktivira trans GADD45 gen, koji ima sposobnost da se veže belkovyyprodukt Sdc2, razrushayatakim način su kompleksa ciklin B / Cdc2. Treće, repressiruettranskriptsiyu p53 gena i ciklin B Cdc2, što smanjuje njihovu sintezu produktov.Sleduet napomenuti da, kako u slučaju zaustavljanja stanice tsiklav G1, G2 odgađanje oštećenje DNA kada se promatraju u kletkahs inaktivirani p53: to je rezultat podavleniyafunktsii fosfataza Cdc25 (Cdc25A na stanice u G1 i G2 Cdc25C u suspenziji), aktiviranje odgovarajući tsikdinzavisimyekinazy. Međutim, u stanicama s oslabljenom funkcijom P53 proiskhoditlish kratke stanke u punktu, te aktiviranje p53 obespechivaetdlitelnuyu staničnog ciklusa, sprečavanje razmnozhenievplot da otkloni nedostatke.
Sljedeća skupina gena p53 regulira kodiraju proteine indutsiruyuschieapoptoz. Tako p53 kontrolira sintezu obje komponente osnovnyhputey indukciju apoptoze i mitohondrijske i stimulirane"receptori smrti", Tako, regulira aktivnostbelkov porodicu bcl-2, potiskujući gena antiapoptotski gena belkaBcl2 i aktiviranjem pro-apoptotički protein Bax, Puma i Noxa.Povyshenie mitohondrijske propusnost membrane i tsitohromaS AIF proteina je postići i gen p53AIP1 trans-aktivacije (egoprodukt lokaliziran u mitohondrijalnom membrani i smanjuje membrannyypotentsial) i PIG3 gen (kodira oksidoreduktaze koji vovlechenav nastajanje kisikovih radikala koji oštećuju membranskog mitohondriyi stimulirajući oslobađanje njihov sadržaj). Poticanje apoptoze smrti zapuskaemogoretseptorami postići trans-aktivacije gena iztakih dva receptora - Fas i Killer / DR5 (receptor za TRAIL). Escheodnoy kao meta je gen nedavno identificiran belkaPidd koji sadrži smrti domenu i prekomjernom ekspresijom indutsiruetapoptoz. Identificiran drugi geni reagiraju na p53 politi (IGF-BP3, PAG608, p85 ciklin G), proizvodi koji potiče apoptozu, ali mehanizmyih apoptotski djelovanje do istražena prilično loše. Krometogo, p53 mogu izazvati apoptozu putem drugih mehanizama koji nisu vezani za njegovu sposobnost da mijenja ekspresiju gena misheney.Tak, mutant p53 transkripcijska aktivnost izgubljena (vrezultate delecije C-terminalnom području, ili mutacije na kodonima 22-23) zadržavaju sposobnost ipak potiču apoptozu u nekim (ali ne sve) vrsta stanica. Pretpostavlja se da je ovaj effektobuslovlen protein-protein interakcije p53. Dakle, s povećanjem funkcionalnu aktivnost p53 može proiskhoditaktivatsiya odmah mnogo načina za indukciju apoptoze, što je očito pruža pouzdanu primjenu.
Od P53 kontrolira aktivnost gena, čiji proizvodi sposobnyvyzvat kao zaustavljanje staničnog ciklusa u raznim fazama i apoptozu, postavlja se pitanje, zašto aktivacije kletkipri p53 sudbini izbora. Ispostavilo se da je on određuje mnozhestvomfaktorov: tip stanica Gistogeneticheskaja (npr normalnyhfibroblastah obično primijetio zastoj staničnog ciklusa, dok je u limfocitima - apoptoza), stupanj aktivacije p53 (a uvelicheniemurovnya njegov izraz povećava vjerojatnost apoptoza), funktsionalnoyaktivnostyu signalizacije pRb- E2F (c inaktivirovannympRb u fibroblastima ili prekomjerno E2F, nema zaustavljanja vG1 i apoptoza), itd Nedavno sam otkrio da je još jedan faktor u određivanju izbor između staničnog ciklusa i apoptoze, je p53 molekule karakter izmjenu sami i / ili proteina-belkovyhvzaimodeystvy. Tako p53, fosforiliran na Ser15 / 20 i atsetilirovannyypo C-kraja, može trans-aktiviranje gena p21Waf1 / CIP1 i vyzyvatostanovku u G1, dok dodatni fosforilacije Ser46pridaet je sposobnost da se trans-aktivirati uz gen p21Waf1 / Cip1i protein gena r53AIP1 i ovaj slučaj je već uočeno apoptoz.Prichem fosforilaciju vjerojatnost Ser46 povećan sa uvelicheniemintensivnosti oštećenja DNA. Nadalje, sposobnost p53-izbiratelnotrans aktivirati proapoptotskih gena (BAX et al.) Uvelichivaetsyapri njegov vezujući protein obitelji ASPP (ASPP1 i ASPP2), koji je karakterističan poteryaekspressii za značajan dio slučajeva rakamolochnoy žlijezde.
Treća velika skupina ciljnih gena p53 geni produktykotoryh kontrolira morfologiju i / ili migraciju stanica (Slika 4B) .tak p53 aktivira gene za trans-oba predstavnici semeystvarasseivayuschih (Scatter) čimbenika -, HGF / SF i / HGF1 MSP i genodnogo članovi obitelji epidermalnog čimbenika rasta HB-EGF (heparin-vezujući EGF) (svi proizvodi od tih gena odnovremennoi mitogenima i motogenic). Tako, trans-aktivira p53 receptor takzhegeny ovih čimbenika - HGF / SF-R (Met) i EGF-R. p53 gena responsivnymitakzhe kemokina fractalkine, a-aktin glatkih mišića i kolagen tipa II1 il1 inhibitor, PAI-1, plazminogena. S drugoystorony potiskuje p53 gena metalloproteinazyI fibronektina i vrstu. Fiziološki Značaj ovog regulacije do ustanovleno.Vozmozhno, to je, barem djelomično, u privlecheniik stanice aktivirane p53 opredelennyhtipov okružuje stanice za remodeliranje / vratiti struktura tkiva u mestevozmozhnogo apoptoze. Moguće je sudjelovanje takvih propisa i vprotsesse morfogeneze.
Posebnu skupinu ciljnih gena p53 može identificirati gene kontroliruyuschieangiogenez. Ključni ulogu u neoangiogenezom ima VEGF (faktor rasta VascularEndothelial stimulira reprodukciju i migratsiyuendotelitsitov) čija ekspresija pod hipoksija povyschaetsya iliaktivatsii određenih onkogena. p53 potiskuje transkripciju kakgena VEGF, i gen HIF-1 (hipoksiju inducirajući faktor 1) - transkriptsionnogofaktora pružanje povećana ekspresija VEGF i njegove retseptorovv odgovor na smanjenje sadržaja kisika (osim što je HIF-1izmenyaet ekspresiju gena koji kontroliraju transport glukoze iglikoliz da prilagođava stanice u uvjetima hipoksije) .Odnovremenno p53 gena trans-aktivaciju proteina ingibiruyuschihangiogenez - trombospondina (TSP) -1, 2 (spetsificheskieretseptory vezivanje na endotelne površine su im apoptoza) Bai-1 uzrok. Stanice se aktivira p53 gore prestanu perenosyatnedostatok kisika izlučivanja inhibitora VEGF i angiogeneze koja sprečava nachinayutsekretirovat obrazovaniyunovyh plovila. Ove funkcije su, očito, više odnoysostavlyayuschey tumora potiskuju djelovanje p53, jer onipredotvraschaet adaptacije na hipoksiju i vaskularizacije u tsentropuholi.
To je otkrio nekoliko desetaka ciljanih p53 gena. Među nihsleduet navedeno gena katalitička podjedinica telomeraze (terc), koji se potisnuti prema p53 (čime se, p53 sudjeluje očito, a da se dobije replikativne starenje stanica, vjerojatno, r53prinimaet ulogu u sazrijevanju staničnih procesa, što nekotoryeiz trans-aktivirani oni geni kodiraju proteine koji repertoar iliinoy diferencijaciju (mišića kreatina, i drugi.).
Posljedice povrede funkcije p53. Karakteristika p53 abnormalnosti opuholevyhkletok ukidanje ili oslabiti sve važne funktsiiopuholevogo supresor p53. Brisanje oba alela gena p53, tj potpune inaktivacije uzrokuje slabljenje G1- i G2-chekpoyntovkletochnogo ciklus, inhibiciju apoptoze, indukcije smanjenje effektivnostireparatsii DNA učinkovitiji prilagodbu hipoksijom i stimulyatsiyuneoangiogeneza, olakšati kontrolu duljine telomera i druge karakteristike ingibirovaniedifferentsirovki neoplasticheskoykletki svojstva. Od posebnog značaja je pojava stanica s inaktivirovannymr53 jake genetske nestabilnosti, koji motor dalneysheyopuholevoy progresije. Gubitak funkcionalnu aktivnost p53 znachitelnouvelichivaet tempo nastupa razmnožavanje stanica s raznymigeneticheskimi abnormalnosti - Promjene u broju i kromosomskih pregradnje, genske mutacije, pojačavanje određenih područja genoma.
Slični učinci opaženi su i najčešće anomalije u novoobrazovaniyahcheloveka p53 - misscnsc mutacije, što je dovelo do sinteze neaktivnogobelka ima dominantno negativan učinak u otnosheniiprodukta netaknutoj alela. Treba primijetiti, međutim, chtostepen manifestacije dominantni negativni učinak mutantne r53variruet ovisno o specifičnim aminokiselinske supstitucije i tipakletok inhibirao funkciju p53 divljeg tipa. Stoga neredkoselektivnoe prednost dobiveni klonovi stanica koje genetskim događa se rezultatedopolnitelnyh brisanja ili mutatsiyai drugi alel gena p53. Istovremeno, tumorske stanice, kakpravilo zadržavaju ekspresiju barem jednoj mutantnoj p53 allelyagena. Očito, to je zbog činjenice da se pojavljuju u rezultatemissens mutacije nova aktivnost mutiranih p53 dopolnitelnyyvklad doprinijeti poboljšanju onkogeni potencijal u stanici. Tako, priobretayasposobnost trans aktiviranog onkogena myc, mutantni p53 se očito teži poremećaja regulacije staničnog ciklusa, od onih primijećenih u delecija gena p53. Novi aktivnostimutantnyh proteina p53 su odgovorni i za dodatni razvoj oslablenieinduktsii apoptoze i otpornost na apoptozu himiopreparatov.V temelji suzbijanje je nekoliko mehanizama: Trans aktivatsiyamutantnym p53 gena Bag1 antiapoptotski proteina (član semeystvaBcl2), sposobnost mutanta p53 vezati i inaktivira gomologr53 proteina p73 (vidi . sljedeći dio), itd Pojavljivanju ustoychivostik specifični antitumorski citostatici mogu svyazanotakzhe neki mutant sa sposobnošću povećanja p53 transkriptsiyugena MDR1 (Multi Drug Resistance-1 - vidi XII.2.1.1). I-ASE genadUTF, proizvod koje blokira učinak 5-fluorouracil iryada drugim antimetaboliti. Treba napomenuti da je mutacija humanih tumora harakternyedlya različito utječu vozniknovenievysheukazannyh aktivnosti. Dakle, zamjena kodona 175 i 248 za aktiviranje gena pridayutsposobnost dUTP-ase, dok mutacije u kodone273 ne uzrokuju stjecanje takve imovine. Stoga ispolzovaniemutatsy p53 kao kriterij za predviđanje chuvstvitelnostik varira kemoterapije može se temeljiti na samo tochnoyidentifikatsii aminokiselinskih supstitucija, a ne za detekciju histokemijskim"normalan" ili "mutantni" pomoschyukonformatsionno s antitijelima p53 specifične.
Tako, mutacije i druge promjene u aktivnosti p53 vyzyvayutodnovremennoe nastanka skup karakteristika svojstva neoplasticheskoykletki kao smanjenje osjetljivosti na razne rasta-supressiruyuschimsignalam (uključujući generira stalne ekspresiju aktivirovannyhonkogenov) imortalizaciju povećana sposobnost preživljavanja u neblagopriyatnyhusloviyah, genetske nestabilnosti, stimulacija neoangiogenezom, blokiranje staničnu diferencijaciju, itd To očito iyavlyaetsya objašnjenje za ovu visoku učestalost p53 mutacijama vsamom različite tumore - oni omogućuju jedan korak preodoletsrazu nekoliko faza napredovanja tumora. Osim toga, mogu biti mutatsiir53 početni događaj (Li-Fraumeni sindrom) ili odrediti početne stupnjeve karcinogeneze i voznikati odabrane već tijekom rasta tumora, pod uvjetom priobretenienovyh korozivne svojstva i otpornost na terapiju.
3.3.4. Homologne p53: p63 i p73
Nedavno dva gena su otkriveni, p63 i p73 proizvoda kotoryhimeyut dovoljno visok stupanj homologije s p53 proteina aktivacije uchastkahtrans, DNA vezanja i oligomerizacije domene, ali znatno razlikuju od njega u C-kraju. Ipak, gen koji kodira unlikefrom p53 za proteinski proizvod u biti prolazi, međutim, niz post-translacijske modifikacije, p73 gena r63i proizvesti nekoliko proteina. Činjenica da je mRNA kazhdogoiz mogu se sintetizirati s dva promotora i dalje podvergatsyaalternativnomu spojeni. Rezultat je 6 izoformbelkov p63 i p73 ima (TA-oblik) ili bez (? DN-oblik) trans-aktivacije domena. Osim toga, formulacije koje sadrže trans aktivatsionnyydomen mogu aktivirati gene osjetljivih na p53-vježbanje i uzrokuju, posebice, apoptoze. Nadalje, TA oblika p63 i p73 može trans aktivirovati broj drugih gena koji sadrže sličnu strukturu responsivnyeelementy koji nisu, međutim, meta p53. Konkretno, oni su trans-aktivirati gene Jag1 Jag2 i proteina - ligand za retseptorovNotch, od kojih je aktivacija igra ključnu ulogu u odabiru sudbykletki u odabiru smjera diferencijacije.
Postoji nekoliko razlika između p53 i njegovih homologa. Dakle, eslir53 izražen u stanicama gotovo svih tkiva, egogomologi izražen samo u određenim vrstama stanica. Na primjer, p63 pretežno se eksprimira u embrionalnim stanicama, stabljike i atakzhe vzroslogoorganizma nediferencirane epitelne stanice, pri čemu je aktivna transkripcijski? DN-form.Predpolagaetsya da ekspresija? DN-p63 oblika daje nedifferentsirovannoesostoyanie stanice. Kada p63 gena knockout miševi primijetio prenatalnayaili postnatalni smrt embrija zbog potpune otsutstviyakozhi epitelilnyh i drugih tkiva (pod pretpostavkom da je svyazanos prerano diferencijaciju matičnih stanica epitelnog iischerpaniem zaliha u trenutku rođenja životinja). Nadalje, eslir53 aktivira kao odgovor na raznim stresovima, to gomologitolko na neke od njih, a zbog vrlo različitih mehanizmov.Nakonets ako p53 djeluje kao supresor tumora i njegove inaktivacije dlyanovoobrazovany karakterističnim, njegovih homologa neimeyut takve funkcije. O tome svjedoče dvije skupine faktov.Vo Prvo, miševi homozigota nokaut p73 gena ne uzrokuje formiranje tumora povysheniyachastoty (p63 gena genom embrija szhiznyu nisu kompatibilni. - vidi gore). Drugo, iz humanih tumora gubitka se nije mogla detektirati ekspresija ili mutacija gena p63 i p73. Naprotiv, često su označeni porast ekspresije tih proteina, koji su obično prepisivanje neaktivan? DN-oblika (tj p63 i r73yavlyayutsya radije proto-onkogena). S tim u vezi, pri čemu poprima populyarnostgipoteza? DN-oblici p63 i p73 proteina funktsioniruyutkak prirodnih inhibitora p53 inhibira svoju funkciju u dominantan negativnomumehanizmu. Zaista, transkripcijski neaktivan tetramerymogut natječu s p53 za spuštanje na DNA molekuli ciljnih gena i / monomera dimera - izdvajaju p53 vezanjem na njegovu molekulsku tvorbu kompleksa neaktivne. To ne isključuje, međutim, da se u poremećaje funkcije p53 aktivira transkriptsionnoyfunktsii homologe (pokazalo da p53 transkriptsiyugena potiskuje p73), koji se mogu djelomično nadoknaditi gubitak funktsiir53 i osigurati, na primjer, normalan razvoj mišje gomozigotnymnokautom gena p53. Ove pretpostavke, kao i drugi aspekti biologicheskihfunktsy homologa p53, potrebna daljnja istraživanja.
 Hondrodisplazija fetus. Mutacije u genima transkripcijskih faktora
Hondrodisplazija fetus. Mutacije u genima transkripcijskih faktora Metafiznaya hondrodisplazija Jenson. Poremećaji sintezu kolagena u fetusa
Metafiznaya hondrodisplazija Jenson. Poremećaji sintezu kolagena u fetusa Abnormalnosti SOX gena i TVH Holt-Oram sindrom. Faktori rasta fibroblasta
Abnormalnosti SOX gena i TVH Holt-Oram sindrom. Faktori rasta fibroblasta X-vezani sindrom hiperprodukcija imunoglobulina m (IgM) dječaka. Mutacija CD40 CD154
X-vezani sindrom hiperprodukcija imunoglobulina m (IgM) dječaka. Mutacija CD40 CD154 Mutacije gonadotropin gene. Mutacije u podjedinice LH i FSH
Mutacije gonadotropin gene. Mutacije u podjedinice LH i FSH Mutacije gonadotropin receptore. Abnormalnosti LH i FSH receptora
Mutacije gonadotropin receptore. Abnormalnosti LH i FSH receptora Novi lijek za liječenje gilotrif raka pluća (afatinib) odobrila FDA
Novi lijek za liječenje gilotrif raka pluća (afatinib) odobrila FDA Proteini imunološkog sustava uzrokuje DNK mutacije koje dovode do raka
Proteini imunološkog sustava uzrokuje DNK mutacije koje dovode do raka Učinak mutacija u ret učinkovitosti terapije medularni karcinom štitnjače
Učinak mutacija u ret učinkovitosti terapije medularni karcinom štitnjače Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya-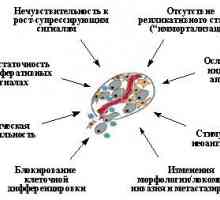 Onkologiya-
Onkologiya-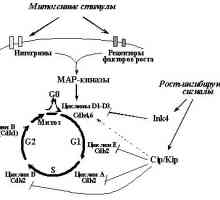 Onkologiya-
Onkologiya-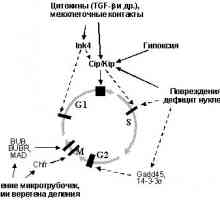 Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Genetika tumora
Genetika tumora
 Mutacije gonadotropin receptore. Abnormalnosti LH i FSH receptora
Mutacije gonadotropin receptore. Abnormalnosti LH i FSH receptora Hondrodisplazija fetus. Mutacije u genima transkripcijskih faktora
Hondrodisplazija fetus. Mutacije u genima transkripcijskih faktora Metafiznaya hondrodisplazija Jenson. Poremećaji sintezu kolagena u fetusa
Metafiznaya hondrodisplazija Jenson. Poremećaji sintezu kolagena u fetusa Genetika tumora
Genetika tumora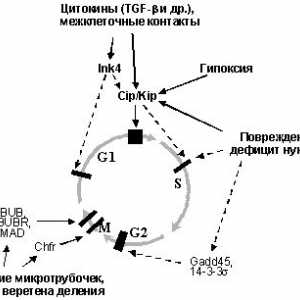 Onkologiya-
Onkologiya-